イントロダクション
静磁場中に置かれた(水素)原子の核スピンは、Zeeman効果によりα位とβ位に分裂しエネルギー差が生じます。生じたエネルギー差に相当する電磁波に共鳴しますが、核種によって、あるいは同一の核種でも原子核の置かれた環境に応じで異なる周波数の電磁波に共鳴します。NMR測定ではこの違い(化学シフト)を利用して化合物に含まれる官能基の種類を推定します。MRIは生体内に豊富に存在する水分子や脂質の密度を画像化します。MRIにおいて、形状だけではなく機能を観たいとなると体内の豊富な1Hだけではなく体外から入れられた標識となる物質の13Cや15Nなどの低感度核のimagingが必要です。そこで、MRIの感度向上が求められてきました。
Zeeman効果により分裂する核スピンの分極率は1ppm程度で、この小ささによりNMRは原理的に低感度です。一方、電子スピンは同様に分裂した場合の分極率は格段に大きく、その差は1Hと比較して660倍となります。NMRやMRIと比べてESRの感度が高いのはこの分極率の違いのためです。NMRやMRIの感度向上のために高磁場化、コイルやシークエンスの高効率化が行われてきましたが、すでにそれぞれの研究は完成形を成しています。さらに高感度を求めるのであれば、NMR現象の原理に立ち戻り新しい技術が必要となります。
そこで、DNP(Dynamic Nuclear Polarization:動的核スピン分極法、動的核偏極法)を用いてNMRの感度を向上させようとする試みが行われてきました。スピン分極率の大きい電子スピンの磁化を核スピンに移して核スピンのスピン分極率を大きくしてNMRの感度を上げます。電子スピンにマイクロ波を照射することで磁化移動を生じさせて、核スピンを超偏極状態(Hyper Polarized)にします。dissolution DNP法は、極低温・強磁場下でスピン分極した電子から核へ分極移動を行いスピン分極率を高くした物質を動物に投与して体内を画像化します。観測対象は13Cや15Nなどの低感度核で、造影剤として体内に入れて13CMRIなどで代謝イメージングを得ます。 一方in vivo DNP-imagingではあらかじめ生体に投与したフリーラジカル(造影剤)の不対電子にDNPを起こして生体内の1Hを画像にして、間接的にフリーラジカルを可視化します。
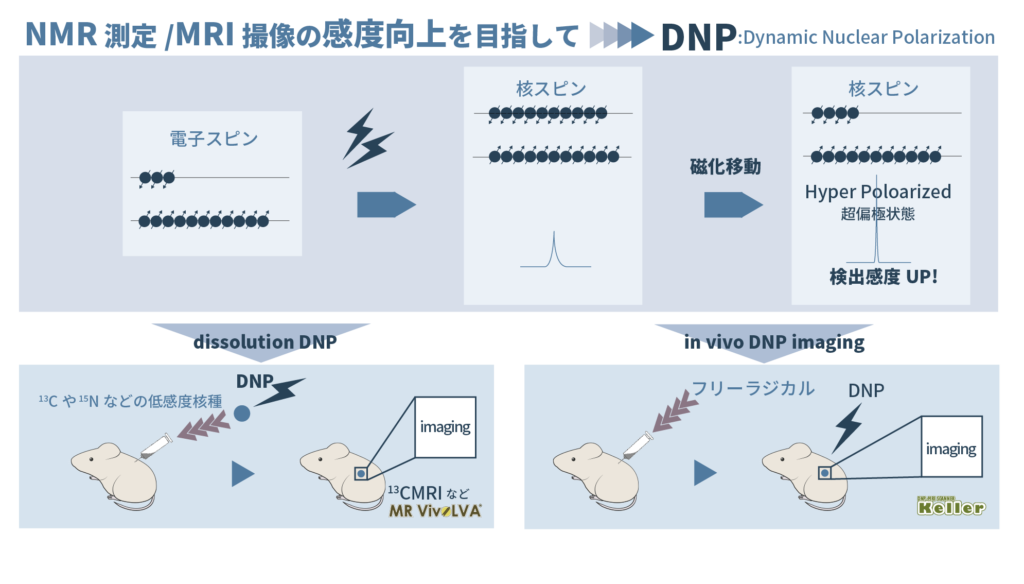
in vivo DNP-imaging
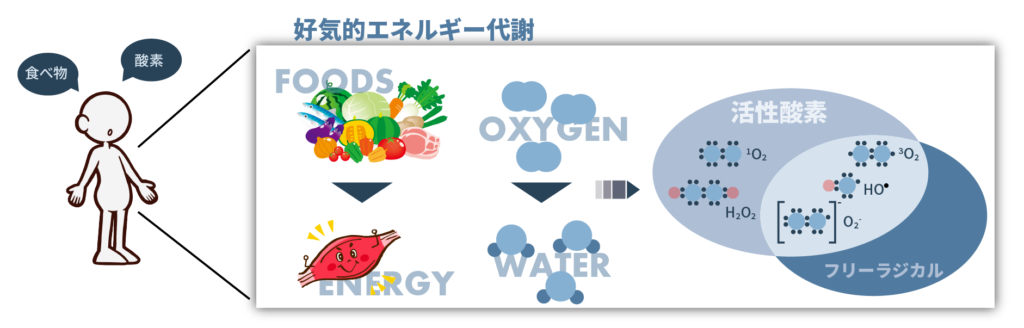
動物は呼吸によって酸素を取り込み、電子の授受により食物をエネルギーに変えます。これを好気的エネルギー代謝といいます。そして、この好気的エネルギー代謝の過程で酸素が水に変わるまでに生成される中間体を活性酸素種(reactive oxygen substance:ROS)といい、生体内で数々の機能発現に関わっています。
活性酸素種の中には不対電子をもつ原子や分子(フリーラジカル)もあります。中でも酸素分子は不対電子を2個持っており、体内に取り込まれて酸化反応の電子の授受に使われる、代表的なフリーラジカルです。生体内の反応は酸化還元が大きくかかわっており、生体内の酸化還元状態を知ることは代謝を知ることに繋がります。
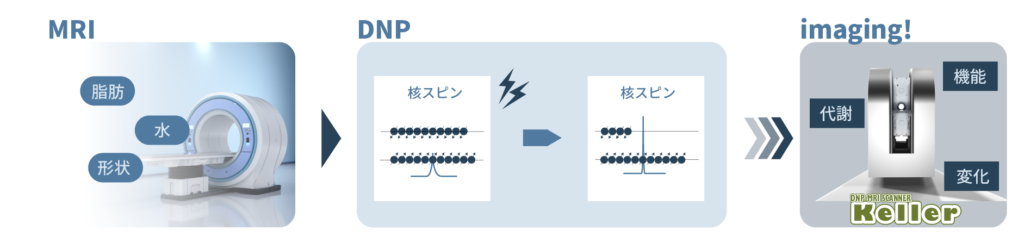
MRIは医療分野では水や脂肪を多く含んだ臓器の形状を画像にすることで診断に利用されてきました。しかし、形状だけではなく代謝など見たい範囲の周囲の変化・動きなどを知る際にはこれまでのMRIでは見えないものが多くあります。そこでDNPと組み合わせて観察部位の形状だけでなく、変化を観ようとするのがin vivo DNP-imagingです。
in vivo DNP-imagingで用いられる造影剤は安定フリーラジカルです。造影剤をマウスなどの小動物に投与したあと体外からマイクロ波を照射して電子スピンを励起します。磁化移動によりその周辺のプロトンの核スピンが超スピン分極状態となり信号強度が増大します。その結果、造影剤の周囲に存在するプロトンの信号強度が高い画像が得られるため、間接的にフリーラジカルが可視化されます。これにより見たい部位に存在するフリーラジカルや、その代謝の様子などを画像として得ることができます。
これらのすべてが常温下で行われるので、より簡便にフリーラジカルの機能を観察することができます。体内の代謝の様子を視覚化することは様々な現象の解明や治療法の開発につながります。
